在上期的团体先容(点击检察)中,从“按年份统计国产与入口生物成品核准文号数目”一图中直觉地看到了生物成品年度核准数目的起升沉伏,这些升沉面前的缘由有哪些?我国生物成品相干的律例从1951年开始的《生物成品律例》和1985年的《更生物成品审批法子》衍变于今,每次律例的衍变是不是都带来了核准数目的变革?本期小编将数据的升沉和律例的衍变联合起来,剖析我国生物成品的核准进程。
1951年公布的《生物成品律例》是我国开始的一部对于生物成品的律例,以后生物成品的律例不停美满,加上《华夏生物成品规程》及《华夏药典》的实行,我国对生物成品的羁系观念和质地尺度不停革新,也慢慢与拥有国际接轨,少少手艺目标可到达WHO的相干恳求。跟着历版药典的公布,对生物成品的质地掌握愈来愈严酷。现行版药典所收载的生物成品种类的质地尺度团体程度与欧洲药典、美国药典及日本药典趋于分歧,个体名目的恳求高于拥有国际尺度。
2002年公布《方剂备案办理法子》(试行),包罗了中药、化药、生物成品的备案办理;2005年公布《方剂备案办理法子》,2007年对《方剂备案办理法子》停止校改。
2015年、2017年国度前后公布《对于鼎新方剂养息用具审评审批轨制的定见》和《对于深入审评审批轨制鼎新勉励方剂养息用具立异的定见》两个大纲性文献。
上述律例的校改,对生物成品备案申诉发生了较着作用,现将上述主要律例分别为六个阶段,剖析律例校改对生物成品备案申诉的作用。六个工夫阶段为:1985年前,1985⑴999年,1999*002年,2002*007年,2007*015年,2015年-于今。
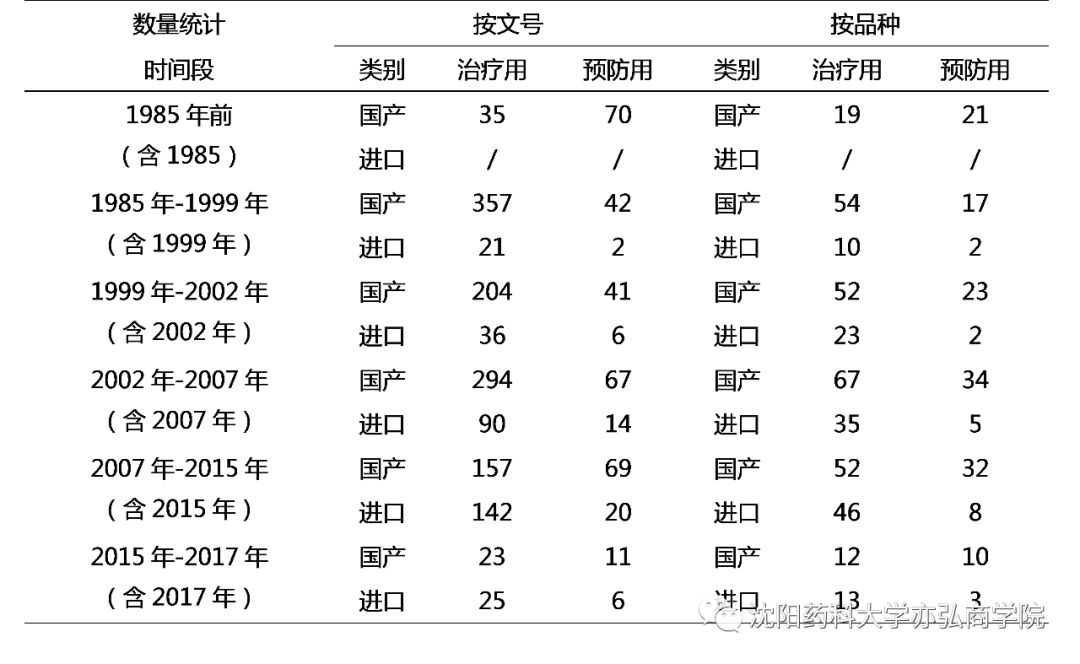
1985年以前,我国的生物制药财产仍以保守生物成品为主,即疫苗和血液成品,整体上这个阶段核准的生物成品仍是疫苗占主宰职位。
1985年以前我国还没有实行GMP,生物成品的出产才能绝对落伍。《生物成品律例》中收录的种类少,质地尺度也较低。此阶段可以或许核准生物成品上市的机构不独一(卫生部及各省级卫生行政部分),核准尺度差别一,质地错落有致。
1985年第一部《更生物成品审批法子》公布,标记着生物成品的备案办理正式归入国度法治办理。不管请求察看或请求出产,均必需向卫生部请求并报送无关材料,明白了生物成品的国度甲第审批轨制。1988年对此法子停止了校改,1993年公布《生物成品办理划定》。
1988年卫生部公布《方剂出产质地办理范例》,1995年卫生手下达卫药发(1995)第53号文献《对于展开方剂GMP认证事情的告诉》,增进企业努力停止GMP认证的同时,也提议再不受理过期未取得认证企业的新药请求的恳求。1996年比拟1995年生物成品获批数目削减50%,与GMP的实行恳求有必定相干。
在这一阶段,医治用生物成品迥殊是重组类产物,获批数目逐年增添,1990年我国核准第一个国产基因工程产物--重组人侵犯素α1b上市。到1998⑴999年,重组类产物获批数目到达岑岭,每一年近60个。医治类生物成品获批总量已远超疫苗获批数目。
此期间我国开端入口生物成品。1989年核准第一个入口医治类生物成品--重组人侵犯素α2b打针液;1995年核准第一个入口疫苗--A群C群脑膜炎球菌多糖疫苗。
1999年版《更生物成品审批法子》明白提议了生物成品临床前药理毒理的手艺恳求,对各方面研讨材料均有了较明白的划定,细化了备案申诉的详细恳求,深化了申诉材料的完备性。1999以前的十年,我国国发生物成品获批数目团体显现高涨趋向,到1999年核准126个,到达颠峰。到2000年时获批数目降至63个,这与律例严酷手艺恳求和申诉材料恳求有必定相干。
1999*002年,固然对生物成品申诉材料的恳求有晋升,但对改剂型和增添规格的审评尺度还不敷严酷,重组人侵犯素、重组人促红素、重组人粒细胞刺激因子等种类均有大方增添规格的种类取得核准。
这一阶段核准的种类,血液成品、重组类产物较多,按方剂办理的体外诊疗试剂因为手艺恳求进步获批数目较少。
2002年以还,我国连续公布生物成品备案办理相干律例和手艺指南,进一步进步了国际生物成品备案审批的手艺门坎。2002年《方剂备案办理法子》(试行)对临床实验和备案分类停止了明白。2005年版《方剂备案办理法子》划定,请求人请求停止临床实验或出产时,由处所药监部分对申诉材料停止情势检察,对研制环境和前提停止现场考查,报送考查陈述。
2003年先后,国度药监局结构编辑了一系列的生物成品手艺指点准绳,进一步范例了研发手艺恳求。
2002年05月09日国度局公布《血液成品去除/灭活病辣手艺方式及考证指点准绳》,明白了血液成品的病毒灭活恳求。2002至2003年,血液成品获批的种类、文号和企业数目并未呈现较大颠簸,至2004年开端显现降落趋向。
2002*004年,国发生物成品获批数目昭著降落,以后年份迟缓高涨,并呈现了大方申诉增添规格的环境。2004年国度药监局公布的《对于增强方剂规格和包装规格办理的告诉》(食药监注函〔2014〕91号),对规格的申诉停止了范例。该告诉公布以后,2004年至2007年工夫段内核准的生物成品数目呈较着降落趋向,剖析与本项战术不有关联。
这短暂段的前期,跟着我国生物成品备案审批的手艺门坎不停进步,生物成品开端显现反复申诉数目削减、种类各类性及立异性增添的趋向。
2007年版《方剂备案办理法子》划定,省级药监部分需结构对药物研制环境及原始材料停止现场核对,国度级查抄机构停止核准前出产现场查抄。同时严酷了质地尺度,划定了出产范围恳求,增添了少少平安性的严重管控的思索。在此时代,国度局和方剂审评中间公布诸多指点准绳及新的手艺尺度,审评尺度愈来愈严酷。
2007年度生物成品获批种类数目创1999年以还的汗青最低半岛app下载,仅为27个,2008年回弹至81个。自2010年以后,国发生物成品获批种类数目连结安稳,根本在14~27个之间。由核准数据看来2007版《方剂备案办理法子》对生物成品的备案申诉发生了较着的作用。比拟之下,入口生物成品受战术律例作用较小,获批入口种类数目的颠峰出此刻2004年和2009年,划分为41个和42个。
2010版《华夏药典》公布后,对生物成品的平安性恳求有较猛进步,对抗生素、防腐剂等残留,产物杂质掌握,冻干庇护剂挑选,原辅料掌握等均提议了明白的恳求。迥殊是对疫苗类产物的恳求有了大幅度晋升。2010年仅核准4家企业的4个疫苗种类上市,对应5个核准文号,较2009年有较大水平下降。2010年以后年份,根本保持在4~7个疫苗种类上市。
这一阶段,我国生物成品企业自立研发才能不停加强,产物拥有较大的立异性,呈现了一批像重组戊型肝炎疫苗、肠道病毒71型灭活疫苗、脊髓灰质炎灭活疫苗、水痘减毒活疫苗(毒株自立分手)、尼妥珠单抗打针液及聚乙二醇重组人发展激素打针液等立异产物。
2015年8月国务院公布《对于鼎新方剂养息用具审评审批轨制的定见》(国发〔2015〕44号),一系列鼎新战术接踵出台。为进一步增进方剂立异,满意民众用药需要,中心办公厅、国务院办公厅公布《对于深入审评审批轨制鼎新勉励方剂养息用具立异的定见》(厅字〔2017〕号42号),要点在鼎新临床实验办理、加速新药和临床急需药物的上市审评审批、增进方剂立异和仿造药成长、增强方剂全性命周期办理等方面提议了指点定见。勉励拥有较着临床代价的立异药及临床急需药物的优先上市。
在上述战术的指导下,2017年,药审中间受理的生物成品立异药已到达68个种类,占中、化、生全数种类的38%,且占比逐年增添。生物成品的立异药首要会合在新疫苗、抗肿瘤药物、消化零碎药物和内排泄零碎药物等范畴。像脊髓灰质炎疫苗、埃博拉病毒病疫苗等产物在国度战术和拥有国际大布景下,投入特别审批法式,更快的获批上市。
2015版《华夏药典》优化了 “生物成品出产用原资料及辅料的质地掌握规程” 公例,对生物成品出产用原资料和辅料的质地掌握明白了恳求。优化人用疫苗泛论、单克隆抗体泛论和重组手艺产物泛论等章节。对部门收载种类的质地尺度也有进一步进步。
2016年国发生物成品取得核准的数目较2015年降落47%,2017年开端上升。这短暂间段战术及律例公布比较浓厚和频仍,方剂审评审修改革对生物成品申诉临床实验作用较大,对备案上市的作用大概在将来五年内才调得以闪现。
2017年10月国度药监局公布《对于调剂入口方剂备案办理无关事变的决议》(局令第35号),该决议明白“在华夏停止拥有国际多中间药物临床实验,许可同步展开I期临床实验,勾销临床实验用药物该当已在境外备案,或已投入Ⅱ期或Ⅲ期临床实验的恳求,抗御用生物成品之外”,“对提议入口方剂临床实验请求、入口方剂上市请求的医治用生物成品立异药,勾销该当取得境外制药厂商地点出产国度或地域的上市允许的恳求”,此项鼎新对入口立异的医治用生物成品无疑是利好的战术。
从2017年头于今的IND受理环境看,新疫苗种类数目加大,疫苗首要研发标的目的会合在人乳头瘤病毒疫苗、肺炎球菌联合疫苗、多价结合疫苗等方面;医治用生物成品,则首要会合在本身免疫性疾病,抗肿瘤单抗药物,细胞医治产物等方面,这些种类仍将是将来五年的申诉热门。
从回首自1985年以还主要律例、文献校改对生物成品备案的作用,不妨看出战术律例和行业成长是相反相成,相互增进的。针对医药财产的特别性,律例对行业成长的引颈感化越发突显。鉴于满意民众用药需要的不停晋升,实时调剂美满生物成品羁系战术,公道指导增进生物成品财产构造进级相当主要。
感激问题拜托单元在研讨实践中赐与的鼎力撑持,感激问题构成员和研讨实践中赐与帮忙和撑持的业界同仁,感激您的概念和经历的瓜分!
本篇实质已在《华夏新药杂志》2018年第27卷第21期中宣布,标题问题为《我国生物成品的备案进程剖析》。转载请关系咱们,援用请说明来历。
经过本期瓜分,我国生物成品的汗青与当今停顿趋向的画卷在慢慢睁开,下期小编将为大师带来我国生物成品的立异环境剖析。敬请等候!
亦弘研讨 硬核瓜分:我国生物成品产物目次剖析及成立我国“紫皮书”的需要性和可行性研讨问题功效